9月5日,寧波大學海洋學院、農產品質量安全危害因子與風險防控國家重點實驗室陳炯研究員團隊在《Cell》經典子刊《Molecular Cell》發表題為“Consecutive palmitoylation and phosphorylation orchestrates NLRP3 membrane trafficking and inflammasome activation”的最新研究成果,深入解析了順序性的棕櫚酰化和磷酸化修飾調控NLRP3蛋白胞內多重膜結構間動態運輸及炎性小體組裝與活化的分子機制。

研究成果發表于Molecular Cell雜志
(原文鏈接:https://www.cell.com/molecular-cell/abstract/S1097-2765(24)00633-6)
NLRP3炎性小體被稱為炎癥反應的核心,作為固有免疫的重要組分在機體免疫反應和疾病發生過程中具有重要作用,一直是生物學領域研究熱點之一。它能夠感知并響應多種病原體和損傷信號,其活化過程需要NLRP3在細胞內特定膜結構上的精準定位、轉運及復合物的組裝。然而,NLRP3在不同膜系統之間的高效、有序運輸及后續炎性小體的組裝與活化機制尚不完全清晰。
該研究首先揭示了由棕櫚酰轉移酶zDHHC1介導的NLRP3在C130和C958位點的棕櫚酰化修飾對其膜定位和運輸的重要性。研究表明,NLRP3在這些位點的棕櫚酰化修飾使其能夠在線粒體、反式高爾基體囊膜(TGN)和內體等多重膜結構之間動態穿梭,并最終轉運至微管組織中心(MTOC)—炎性小體組裝的關鍵場所。

進一步的研究發現,除了棕櫚酰化修飾介導的NLRP3向MTOC的轉運外,NLRP3在到達MTOC后的磷酸化修飾也是炎性小體活化與裝配的關鍵。研究團隊發現,LATS1和LATS2蛋白激酶在Priming階段預先被招募至MTOC,在NLRP3到達后通過磷酸化其S265位點,促進NLRP3構象變化,從而與NIMA相關激酶7(NEK7)相互作用。這一事件解鎖了多聚化NLRP3的“籠狀”結構,驅動了炎性小體的組裝與活化。
同時,研究者還通過小鼠和斑馬魚模型,進一步驗證了NLRP3棕櫚酰化修飾在進化中的保守性及zDHHC1對NLRP3棕櫚酰化修飾功能的重要性。zDHHC1缺失的膿毒血癥動物模型炎癥反應顯著減弱,存活率顯著提高,暗示抑制zDHHC1催化的NLRP3棕櫚酰化修飾可能成為治療NLRP3相關炎癥疾病的新策略。
綜上,該研究系統性地揭示了NLRP3在炎性小體活化過程中復雜的多重翻譯后修飾對其膜轉運及后續活化的影響,并為NLRP3介導的炎癥反應提供了新的治療靶點。
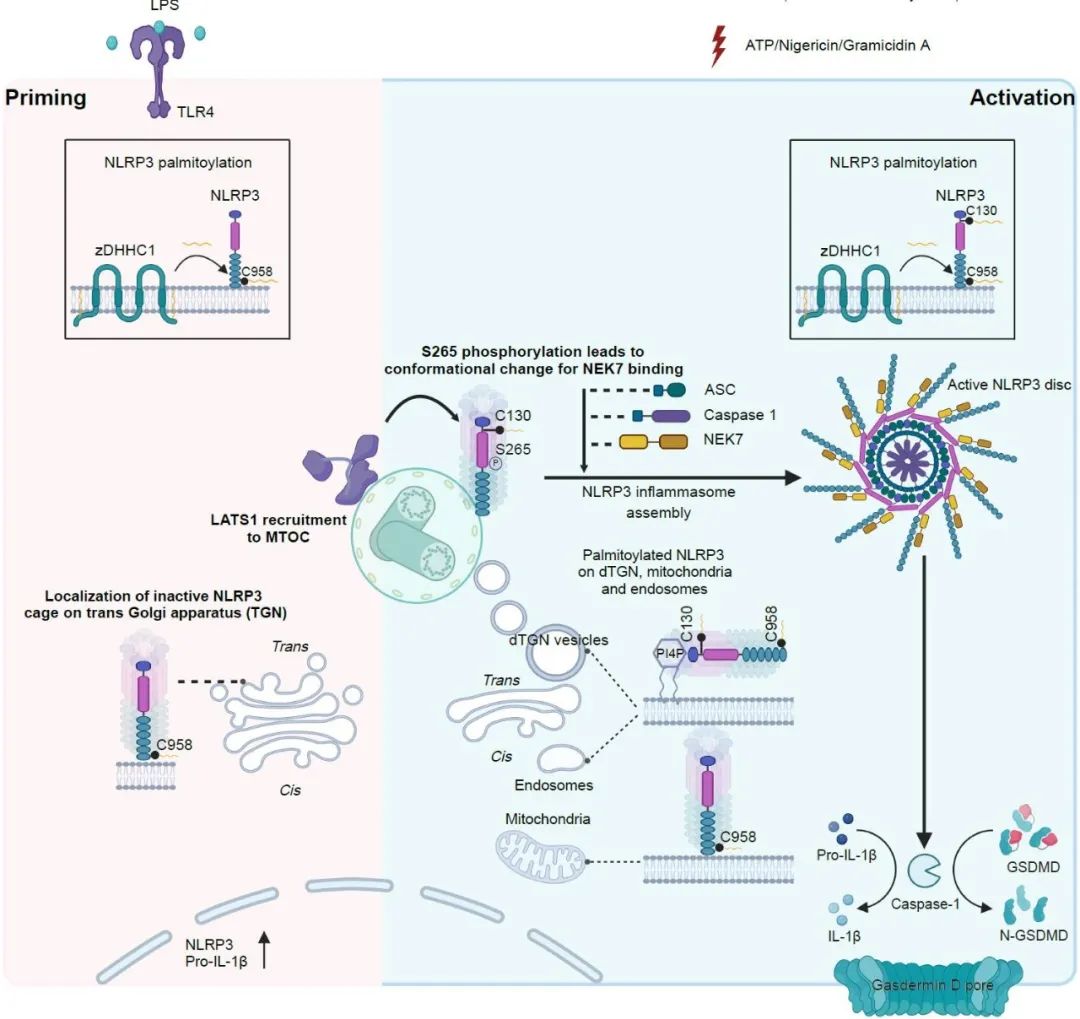
順序性的棕櫚酰化和磷酸化修飾調控NLRP3蛋白胞內多重膜結構間動態運輸及炎性小體組裝與活化的機制
寧波大學陳炯研究員團隊聶力副教授、費辰杰助理研究員、西安交通大學范義增博士及哈佛大學博士后黨法斌為該論文的共同第一作者。寧波大學博士研究生趙紫越、朱婷芳、吳翔宇,碩士研究生戴婷、潘婧,助理研究員胡洋,以及哈佛大學羅鴻博教授及博士后Arumugam Balasubramanian為該論文的共同作者。陳炯研究員為該論文的通訊作者和Lead Contact,聶力副教授和哈佛大學魏文毅教授為共同通訊作者。寧波大學為該研究的第一完成單位。該工作得到了國家自然科學基金項目、浙江省自然科學基金項目、寧波市自然科學基金重點項目和農產品質量危害因子與風險防控國家重點實驗室高級別科技成果獎培育項目等資助。
中國-博士人才網發布
聲明提示:凡本網注明“來源:XXX”的文/圖等稿件,本網轉載出于傳遞更多信息及方便產業探討之目的,并不意味著本站贊同其觀點或證實其內容的真實性,文章內容僅供參考。






















